Андрогенный дефицит у мужчин (мужской гипогонадизм) — это клинический и биохимический синдром, характеризующийся снижением уровня мужских половых гормонов (прежде всего тестостерона), возникающий на фоне функциональной недостаточности яичек.
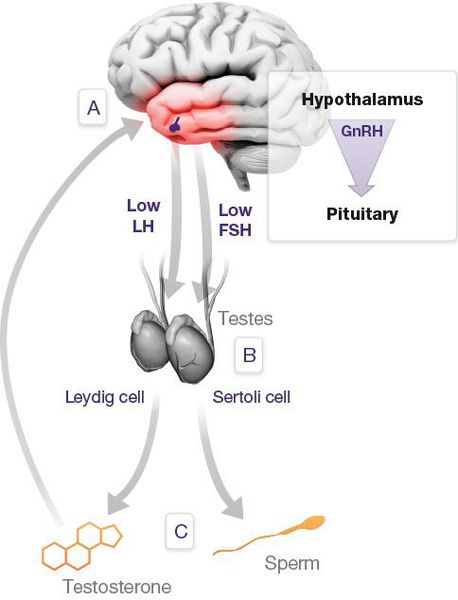
Механизм развития андрогенного дефицита
Последние научные исследования убедительно доказали огромную роль дефицита основного мужского полового гормона — тестостерона — в формировании и развитии большинства урологических заболеваний у мужчин, в том числе рака предстательной железы и почек.
Существует устойчивое мнение, что проблемы, связанные с низким тестостероном, бывают только у пожилых мужчин. На самом деле это далеко не так. Современные данные показывают, что развитие андрогенного дефицита может наступить в любом возрасте.
Первое современное мультицентровое мегаисследование мирового значения возрастного андрогенного дефицита MMAS (2000) выявило основные тенденции к снижению уровня общего тестостерона в крови у мужчин на 0,8% в год. Наряду с этим, концентрация глобулина, связывающего половые гормоны (ГСПС), увеличивается на 1,6% в год, что позволяет позиционировать ГСПС как диагностический фактор возрастного андрогенного дефицита.
Дальнейшее изучение проблемы показало, что уровень андрогенной недостаточности у мужчин 41–80 лет составляет более 35%, что является серьёзным показателем. По исследованиям C. McHenry Martin (2013 год), более 6 млн американских мужчин имеют пониженную концентрацию гормона тестостерона в крови, что проявляется депрессией, пониженной работоспособностью и сердечно-сосудистыми заболеваниями. А исследование, проведённое в Швеции среди мужчин в возрасте 33–46 лет, показало, что частота нарушений эрекции в этих группах отражала низкий уровень общего тестостерона в крови, который оказался ниже у 45-летних испытуемых по сравнению с мужчинами в возрасте 33 лет.
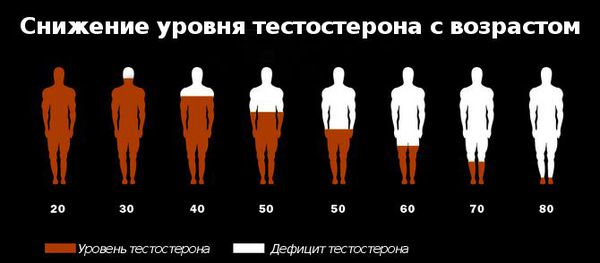
Снижение уровня тестостерона с возрастом
Таким образом, дефицит андрогенов является значимым фактором для каждого мужчины и требует постоянного внимания как со стороны самого пациента, так и со стороны врачей различных специальностей.
Причины андрогенного дефицита
I. Тестикулярные причины (связанные с нарушением работы яичек). Их принято разделять на приобретённые и врождённые.
- Приобретённые причины АД:
- возрастное атеросклеротическое поражение сосудов тестикул;
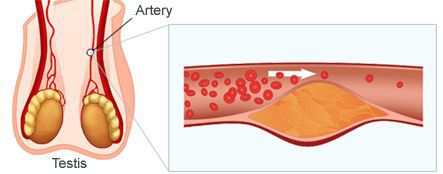
Атеросклероз сосудов тестикул
- последствия воспалительных заболеваний (после половых инфекций, туберкулёза, саркоидоза, эпидемического паротита, то есть ушной свинки);
- вредные привычки (злоупотребление алкоголем, никотином, наркотическими веществами);
- кардиологические заболевания (сердечная недостаточность, артериальная гипертензия), как следствие — нарушение тестикулярного кровотока;
- перегревание яичек (постоянное посещение бань, саун, непривычные климатические условия);
- состояние после лечения онкологических заболеваний — химиотерапии, лучевой терапии;
- опухоли и травмы яичек.
- Врождённые причины:
- гипогонадизм (недоразвитие яичек);
- крипторхизм (неопущение яичек из брюшной полости в мошонку);
- синдром Кальмана (наследственное нарушение — недоразвитие яичек в сочетании с нарушением обоняния и снижением уровня предшественников тестостерона);
- синдром Прадера — Вилли;
- синдром Клайнфельтера (наличие дополнительной женской половой X-хромосомы);
- синдром Паскуалини (синдром «фертильных евнухов»);
- гипофизарные причины — опухоли гипофиза и гипоталамуса, гиперэстрагения (повышение уровня женских половых гормонов), применение анаболических стероидов (например, в культуризме).
II. Другие причины АД:
- резкое снижение иммунитета на фоне аутоиммунных заболеваний, в том числе на фоне ВИЧ и СПИДа;
- ожирение;
- хронические обструктивные болезни лёгких;
- сахарный диабет;
- высокий уровень холестерина;
- заболевания щитовидной железы;
- сильный стресс и постоянное переутомление, различные перенесённые операции;
- витаминная недостаточность (прежде всего, витамина D);
- гемохроматоз (повышенное содержание железа в крови);
- хронический простатит и везикулит.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы андрогенного дефицита
К симптомам андрогенного дефицита относятся следующие признаки:
- снижение либидо (полового влечения);
- ухудшение эрекции;
- снижение объёма эякулята (количества спермы, выделяемой после оргазма);
- выпадение волос;
- истончение и дряблость кожи;
- снижение массы тела;
- увеличение грудных желёз;
- постоянная усталость, снижение общей энергии;
- потеря мышечной массы;
- резкое увеличение жировых отложений;
- снижение массы костной системы, возникновение остеопороза — хрупкости костей;
- немотивированные перепады настроения (депрессия, нарушение внимания, памяти, раздражительность, нарушение сна).
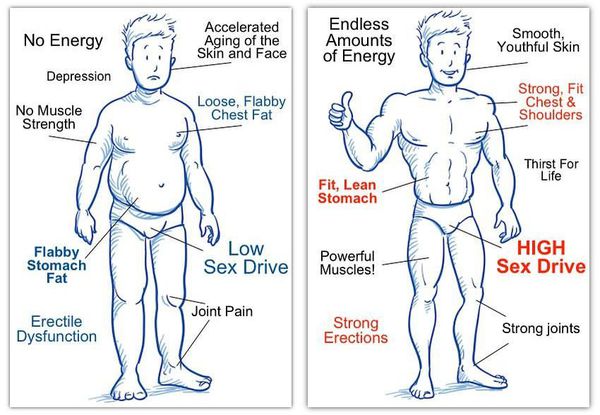
Мужчина при дефиците мужских половых гормонов
Если андрогенная недостаточность возникла до начала полового созревания, то тело приобретает характерную высокорослость с евнухоидными пропорциями. При этом размах рук превышает длину тела, а ноги оказываются длиннее туловища. В результате, такие пациенты сидя выглядят низкорослыми («сидячая карликовость»), а стоя — очень высокими («стоячий гигантизм»).
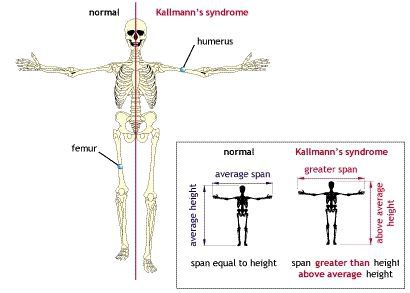
Размах рук при андрогенном дефиците
Длительная андрогенная недостаточность приводит к хрупкости костей (остеопорозу), что может сопровождаться патологическими переломами позвонков и бедренных костей, болями в спине.
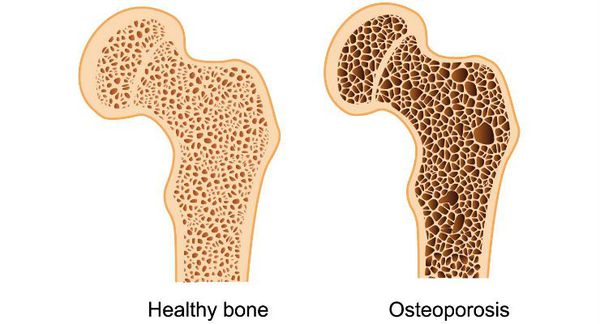
Развитие остеопороза
Дефицит андрогенов прямо не ведёт к увеличению подкожной жировой ткани, но распределение жира приобретает женский характер (отложения на бёдрах, ягодицах, нижней части живота). Мышечная масса тела, наоборот, уменьшается.
В том случае, если андрогенный дефицит возник до наступления полового созревания, длина гортани не увеличивается и огрубление голоса не происходит.
Несмотря на высокий рост, таких пациентов принимают за женщин, особенно по телефону, что порождает у них дополнительные комплексы.
Сохраняется прямая граница волос надо лбом, борода не растёт или растёт очень плохо, почти не требует бритья. Оволосение тела очень скудное.
Ещё один типичный признак — раннее появление тонких морщин вокруг глаз и рта. Кроме того, в результате отсутствия стимуляции сальных желёз кожа остаётся сухой. Анемия и плохое кровоснабжение определяют сильную бледность кожи.
Также важный признак — снижение или полное отсутствие способности различать запахи (вероятность синдрома Кальмана). Такие больные не способны ощущать, например, запах ванилина, лаванды и другие ароматы, но сохраняют способность различать вещества, раздражающие тройничный нерв (нашатырный спирт).
Снижение уровня тестостерона может вызвать увеличение грудных желёз у мужчин. В большинстве случаев, гинекомастия бывает двухсторонней, очень редко — односторонней. При выраженном, особенно одностороннем увеличении, пациента направляют на маммографию для исключения рака грудных желёз.
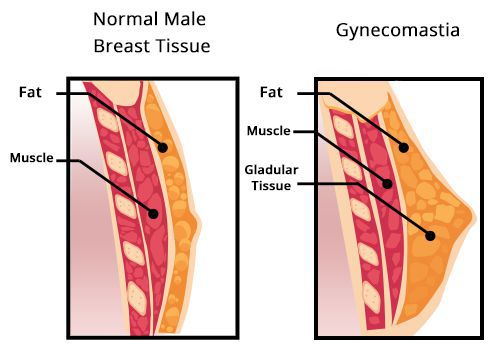
Гинекомастия
Увеличение груди сопровождается ощущением стеснения в груди и повышенной чувствительностью сосков. Нередко гинекомастия развивается у мальчиков при половом созревании (в возрасте 12–14 лет), но через 2–3 года исчезает. При ожирении картина становится ярче и сохраняется дольше. Иногда увеличение грудных желёз происходит у мужчин при старении.
В сочетании с маленькими плотными яичками, гинекомастия типична для синдрома Клайнфельтера.

Гинекомастия при синдроме Клайнфельтера
Быстрое развитие гинекомастии может говорить о наличии гормонально-активной опухоли яичек. Характерная триада симптомов включает гинекомастию, утрату полового влечения и опухоль яичка. Причиной гинекомастии могут быть и общие заболевания: цирроз печени или почечная недостаточность.
Патогенез андрогенного дефицита
Патогенез андрогенного дефицита многообразен и зависит от конкретных причин. Рассмотрим основные моменты патогенеза андрогенной недостаточности.
Возрастной андрогенный дефицит
Патогенетические звенья возрастного андрогенного дефицита у мужчин запускаются, прежде всего, атеросклеротическими факторами, которые постепенно облитерируют (заращивают) заинтересованные сосуды. Это приводит к снижению кровотока в мужских гонадах, соответственно — к уменьшению синтеза тестостерона клетками Лейдига.
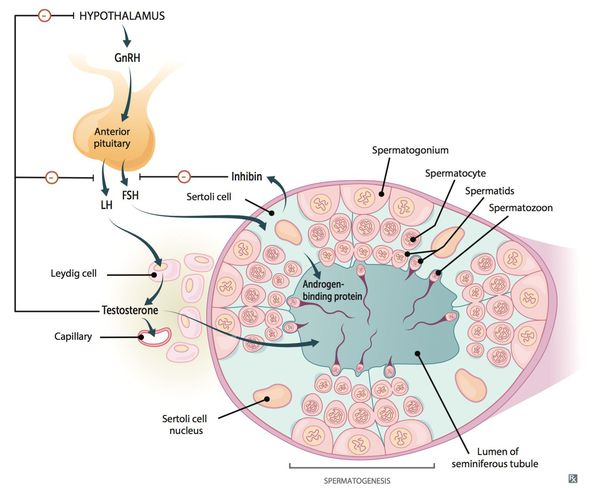
Выработка тестостерона
По мере прогрессирования процесса увеличивается чувствительность заднего отдела головного мозга — гипоталамуса — к тестостерону.
Параллельно, происходит увеличение концентрации в крови гонадотропинов, что ещё более усугубляет ситуацию.
Андрогенный дефицит при синдроме Кальмана
Интересен механизм развития патологических нарушений при синдроме Кальмана. В период развития нормального плода предшественники гонадотропин-рилизинг-зависимых гормонов — специальных нейронов — перемещаются из обонятельного эпителия слизистой носа к своей постоянной точке в гипоталамусе. У эмбриона с синдромом Кальмана, сцепленным с Х-хромосомой, это движение нарушается. Предшественники гонадотропин-рилизинг-зависимых гормонов не выходят из обонятельного эпителия и поэтому не влияют на специфические клетки гипофиза.
Основная характеристика синдрома Кальмана — незавершённое половое созревание или полное его отсутствие. Средний объём яичек у больных с синдромом Кальмана составляет не более 3 мл.
Витаминная недостаточность
Современные исследования показали огромную значимость недостатка витамина D у мужчин, в развитии андрогенного дефицита и снижения уровня тестостерона. Недостаток витамина D — это новая эпидемия XXI века, которая вызвана значительным снижением пребывания на солнце людей, которые проживают севернее 35-й параллели.
По большому счёту, витамин D вовсе не является витамином. Скорее это провитамин, точнее — гормон, который регулирует многие процессы в организме. Понятие «витамин D» подразумевает несколько одинаковых по строению форм витамина D, принадлежащих к классу сексостероидов — D1, D2, D3, D4, D5. Только D3 является истинным витамином D.
Витамин D образуется из продуктов питания и под воздействием солнечных лучей (ультрафиолета). Для преобразования в активную форму он должен пройти двухступенчатый процесс гидроксилирования:
- сначала процесс происходит в печени — витамин D превращается в 25-гидроксивитамин D — 25-(OH)D;
- затем гидроксилирование происходит в почках с образованием активного 1,25-дигидроксивитамина D — 1,25-(OH)2D (кальцитриола).
Последние работы по синтезу тестостерона показали прямую корреляцию (взаимосвязь) между соотношением уровня витамина D и андрогенным недостатком у мужчин.
Так, масштабное европейское исследование EMAS (2012) доказало прямые соотношения между концентрациями витамина D и тестостерона у мужчин. Уровень 25-(OH) витамина D3 хорошо соотносился с уровнем общего и свободного тестостерона и недостаточно взаимодействовал с концетрацией эстрадиола и лютеинизирующего гормона (ЛГ), с учётом возраста.
Дефицит витамина D достоверно отражал динамику у мужчин с компенсированным и вторичным гипогонадизмом.
Сложилось мнение, что дефицит витамина D и связанная с ним андрогенная недостаточность являются важными эндокринологическими механизмами у мужчин, нарушающими соотношение жиросинтезирующих (пролактин, инсулин, кортизол) и жиросжигающих гормонов (гормон роста, катехоламины, половые и тиреоидные гормоны). Данная проблема находится в стадии широкого изучения.
Стрессовые факторы
В стрессовых ситуациях в организме происходит перенапряжение симпатоадреналовой системы, в коре надпочечников вырабатывается большое количество различных гормонов и биологически активных веществ:
- мужские и женские половые гормоны (тестостерон и эстрогены);
- минералкортикоиды (альдостерон);
- катехоламины (адреналин, норадреналин, дофамин);
- глюкокортикоиды (кортикостерон и кортизол).
Кортизол синтезируется при стрессовых ситуациях, которые сочетаются с неудовлетворительным питанием и сопутствующими физическими перегрузками, пытается поддержать уровень глюкозы в крови.
В случае затяжного хронического стресса образуется повышение его физиологической концентрации, что негативно отражается на основном мужском гормоне — тестостероне — и резко уменьшает его концентрацию в крови.
Классификация и стадии развития андрогенного дефицита
По уровню основного мужского гормона тестостерона:
- абсолютная андрогенная недостаточность — снижение общего тестостерона ниже 12 нмоль/л;
- относительная андрогенная недостаточность — постепенное снижение уровня основного мужского гормона в динамике (по годам), не выходящее за нижние нормальные значения. Термин также применим, если нарушено соотношение тестостерона и ГСПГ.
По характеру поражения:
- первичный;
- вторичный.
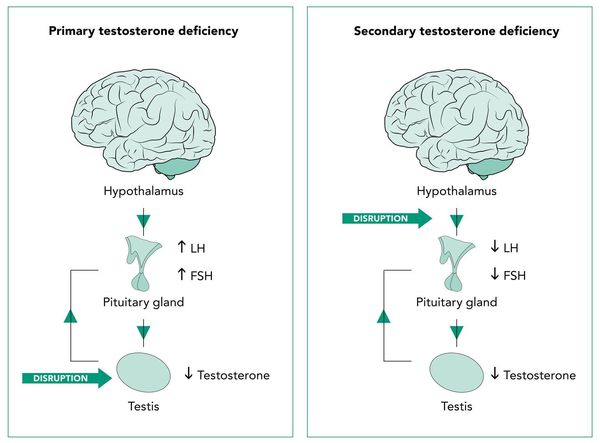
Первичный и вторичный андрогенный дефицит
С учётом времени выявления по отношению к половому созреванию:
- препубертатный (до и в течение полового созревания);
- постпубертатный (после завершения полового созревания).
В зависимости от причины:
- врождённый;
- приобретённый;
- идиопатический (вне зависимости от других поражений).
По преимуществу клинических проявлений:
- с преобладанием сердечно-сосудистой симптоматики;
- с психоневрологической симптоматикой;
- с эндокринными нарушениями;
- с нарушениями мочеполовой сферы.
Осложнения андрогенного дефицита
При отсутствии полноценной терапии больного с андрогенным дефицитом симптоматика усугубляется, и те симптомы, которые проявлялись в лёгкой степени, становятся прямыми осложнениями нарастающего андрогенного дефицита.
К осложнениям андрогенного дефицита относятся:
- снижение половой активности;
- эректильная дисфункция (вплоть до импотенции);
- снижение работоспособности, плохая устойчивость к стрессам;
- утрата вторичных мужских половых признаков и появление женских (гинекомастия);
- остеопороз (ломкость костей);
- алопеция (выпадение волос);

Выпадение волос, связанное с нехваткой мужских половых гормонов
- гиперэстрогения (увеличение женских половых гормонов в организме);
- сексуальные перверсии (отклонения);
- когнитивные нарушения (снижение интеллекта, нарушение памяти, неспособность сконцентрироваться);
- психические нарушения (раздражительность, депрессии, суицидальные настроения);
- заболевания сердечно-сосудистой системы;
- преждевременное старение;
- сокращение срока жизни.
Диагностика андрогенного дефицита
Анамнез заболевания
Обращается внимание на снижение общего тонуса организма, плохой рост бороды и усов, отсутствие спонтанных утренних и ночных эрекций, ослабление сексуального влечения и эротических фантазий.
Выясняется, какими заболеваниями болел пациент на протяжении жизни, были ли травмы, повреждения яичек, имелись ли подобные проблемы у родителей и близких родственников.
Нужно знать, какие лекарственные препараты принимал и принимает сейчас пациент, подвергался ли он внезапным термическим и химическим воздействиям.
Также следует учитывать интенсивность физических нагрузок и вредные привычки (курение, пристрастие к алкоголю).
Физикальное обследование
При осмотре пациента необходимо обращать внимание на клинические проявления андрогенного дефицита (выпадение волос, снижение массы тела, увеличение грудных желёз и т. д.).
- Яички в норме имеют плотную консистенцию. В отсутствии стимулирующего действия ЛГ и ФСГ они становятся мягкими. Объём яичек определяют пальпаторно и сравнивают с шариками определённых размеров (орхидометр Прадера).

Орхидометр Прадера
У здоровых мужчин объём каждого яичка составляет в среднем 18 мл и колеблется от 12 до 30 мл. Уменьшение объёма яичек может говорить о наличии андрогенного дефицита.
- Половой член при гипогонадизме, возникающем до начала полового созревания, остаётся очень маленьким (инфальтильным). Если же гипогонадизм с андрогенным дефицитом возник после полового созревания (пубертата), то размеры полового члена уже не меняются. У мужчин европейской расы длина полового члена в состоянии эрекции колеблется от 11 до 15 см.
- Предстательная железа при ректальном исследовании (через задний проход) имеет гладкую поверхность и форму каштана. При дефиците андрогенов объём железы остаётся малым и с возрастом не увеличивается. Тестообразная мягкая консистенция указывает на простатит, общее увеличение — на доброкачественную гиперплазию, бугристая поверхность и твёрдая консистенция — на рак.
Вспомогательные методы диагностики
- Ультразвуковое исследование мошонки (УЗИ) позволяет получить изображение содержимого мошонки, не оказывая вредного воздействия на яички.
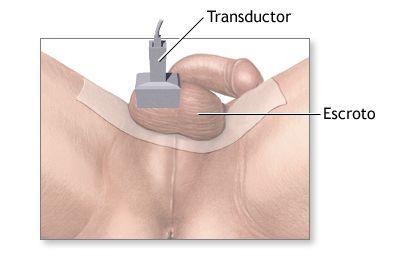
УЗИ мошонки
Нормальные яички и их придатки на эхограмме выглядят гомогенными (однородными) структурами.
С помощью ультразвука можно достоверно установить объём яичек, что очень важно. По формуле объёма эллипсоида получают точные результаты, имеющие большое значение для контроля лечения (например, при лечении гипогонадизма гонадотропинами).
- Доплеровская эхография позволяет оценить кровоток в яичке и семенном канатике.
- Трансректальное ультразвуковое исследование предстательной железы применяется в дифференциальной диагностике андрологических заболеваний. ТРУЗИ применяется в диагностике простатита, гиперплазии простаты и рака. С помощью трансректального исследования можно обнаружить кисты, фиброз, камни внутри железы и другие образования.
- Термография позволяет выявить повышенную температуру на стороне повреждённого яичка, перегревание его в результате венозного застоя и на фоне варикоцеле (варикоза яичковой вены). Термографию производят с помощью термочувствительной плёнки или портативным датчиком с термоизмерителем непрерывно на протяжении 24 часов.
- Измерение минеральной плотности костей (денситометрия) позволяет с помощью ультразвука или рентгена выявлять даже минимальные потери костной массы (до 2%).
Лабораторная диагностика
С помощью лабораторных исследований определяются следующие показатели:
- Тестостерон — основной мужской гормон. В норме его содержание в крови составляет 12-40 нмоль/л. Концентрация тестостерона в сыворотке крови на 20–40% выше в утренние часы, чем в вечерние. Поэтому следует проводить как минимум две пробы на уровень тестостерона. Кратковременные и интенсивные физические нагрузки сопровождаются повышение тестостерона в крови, тогда как длительная тяжёлая работа или изнуряющие тренировки снижают уровень гормона. Тестостерон можно определить и в слюне. Норма — 200-500 пмоль/л. Концентрация гормона в слюне коррелирует с уровнем свободного тестостерона в сыворотке. Особенно это удобно для контроля заместительной терапии тестостероном самим пациентом.
- ГСПГ (глобулин, связывающий половые гормоны) — белок, с которым связывается тестостерон. На долю свободной фракции тестостерона приходится всего 2%. Поэтому очень важно знать уровень ГСПГ. В норме он равен от 17 до 68 нмоль/л. После чего по специальной формуле рассчитывается уровень свободного и биологически доступного тестостерона.
- Витамин D — группа биологически активных веществ, скорее провитамины (в том числе холекальциферол и эргокальциферол). В последнее время доказано его большое значение в синтезе тестостерона. Пограничный уровень 25-гидрокси-холекальциферола в крови составляет 30-60 нг/мл (75-150 нмоль/л).
- Ингибин В — отражает секрецию клеток Сертоли, вырабатывается ими же, участвует в регуляции гипофизарного ФСГ. В норме равен 147-365 пг/мл.
- ЛГ (лютеинизиирующий гормон) — продукт секреции передней доли гипофиза, стимулирует клетки Лейдига, вырабатывающие тестостерон. В норме равен 1–10 мМЕ/мл.
- ФСГ (фолликулостимулирующий гормон) — важнейший показатель мужской плодовитости. Его основная функция — сперматогенез, выработка спермы, способной к оплодотворению. Деятельность мужских половых органов невозможна без этого гормона. Норма — 3,5-12,5 мМе.
- Пролактин — в основном, женский половой гормон. Берётся при условии неясных случаев эректильной дисфункции, увеличении грудных желёз, подозрении на аденому гипофиза. Он влияет на уровень эрекции, продолжительность полового акта, принимает участие в синтезе спермы. Норма — 53-360 мЕд/л.
- Эстрадиол — женский гормон, образующийся путём трансформации тестостерона и андростендиона, вырабатывается в мужском организме в значительно меньшем количестве, чем в женском, однако имеет свои важные функции. Он также участвует в синтезе спермы, половом акте, отвечает за влечение к противоположному полу. Норма — 10-50 пг/л.
- ХГ — хорионический гонадотропин, отвечает за половое развитие мужчин, стимулирует работу яичек, отвечает за уровень тестостерона и зрелых сперматозоидов. Норма — 0-5 мЕд/м.
- ТТГ, Т3, Т4 — показатели работы щитовидной железы (тиреотропный гормон и другие), находятся в тесной связи с тестостероном и другими гормонами.
- Глюкоза в крови, уровень инсулина, гликозированный гемоглобин, С-пептид, лептин — показатели углеводного обмена, усвояемости глюкозы и промежуточных продуктов.
- Липидный спектр крови — соотношение липопротеидов высокой, средней и низкой плотности, определяет уровень атеросклероза, важен при старении и ожирении.
Лечение андрогенного дефицита
Основная цель лечения — улучшение самочувствия пациента и его сексуального здоровья путём восстановления уровня тестостерона в крови до нормальных значений.
Выбор метода терапии определяется формой заболевания, факторами риска и планами пациента по рождению ребёнка.
Следует иметь в виду временное снижения уровня тестостерона на фоне острых или хронических заболеваний, которые должны быть исключены при тщательном обследовании и повторном измерении уровня андрогенов. Терапия складывается из назначения:
- препаратов тестостерона;
- заместительной витаминной терапии (особое место занимает витамин D);
- препаратов ХГЧ — хорионического гонадотропина человека.
Тестостеронотерапия
Показания для назначения препаратов тестостерона:
- мужчины с признаками андрогенного дефицита;
- дисгенезия (врождённые хромосомные аномалии) тестикул на фоне доказанного снижения уровня тестостерона;
- гипопитуитаризм (гипофизарная недостаточность) на фоне нарушение функции передней доли гипофиза.
Противопоказания к назначению заместительной терапии тестостероном:
- рак предстательной железы;
- рак грудной железы;
- выраженные нарушения спермограммы (снижение общего количества сперматозоидов, их подвижности, уменьшение концентрации нормальных форм спермиев);
- выраженная гемоконцентрация (при гематокрите свыше 50%);
- выраженная обструкция нижних мочевых путей при гиперплазии предстательной железы последних стадий;
- уровень ПСА (простатспецифического антигена) более 4 нг/мл;
- синдром сонного апноэ (нарушения дыхания).
Принципы терапии
Выбор препарата тестостерона должен быть осознанным решением пациента. Лечащий врач должен показать больному преимущества и недостатки различных форм заместительной терапии и остановиться на оптимальном варианте.
Тестостероны короткого действия могут быть эффективнее пролонгированных форм на начальном этапе заместительной терапии.
Для возмещения андрогенного дефицита существуют различные формы препаратов тестостерона:
- таблетированные формы (“Галотестин”, “Андриол”, “Провирон”, “Метандрен”);
- инъекционные препараты (“Небидо”, “Сустанон 250”, “Омнадрен 250”, “Деластерил”, “Тестостерона пропионат”);
- накожные (трансдермальные) гели, мази и пластыри (“Андрогель”, “Тестодерм”, “Андромен”, “Андрактим”);
- подкожные импланты тестостерона.
Все они имеют разную концентрацию тестостерона и различную биодоступность.
Следует понимать, что каждый человек индивидуален, поэтому важной задачей становится постоянный мониторинг прироста тестостерона на фоне заместительной терапии андрогенами. Учитывается и тот факт, что в среднем за сутки у взрослого мужчины образуется 8-15 мг эндогенного тестостерона.
В настоящее время таблетированные формы для коррекции андрогенного дефицита практически не используются ввиду низкой эффективности и влияния на слизистую желудочно-кишечного тракта. Подкожные импланты также не нашли широкого применения.
Из инъекционных форм получили распространение препараты с длительным андрогенным эффектом: “Небидо” и “Омнадрен 250”. Сохраняют своё значение тестостероны короткого и среднего действия — “Тестостерона пропионат” и “Сустанон 250”.
Из накожных препаратов неплохо себя зарекомендовал “Андрогель”.
“Тестостерона пропионат” — «эталонный» препарат тестостерона короткого действия (работает до 2-3 суток). Он может применяться для лечения андрогенного дефицита в случаях, когда требуется быстро и эффективно поднять уровень тестостерона:
- на начальных этапах заместительной терапии;
- при аллергических фонах;
- для коррекции уровня тестостерона при получении длинных форм андрогенов;
- для лечения детей с гипопитуитаризмом (но не подростков — использование препарата противопоказано!).
Кроме того, его применяют короткими курсами при олигоспермии.
“Тестостерона пропионат” является самым первым и “старейшим” препаратом тестостерона в мире, который назначают и по сей день. Уже в 1940 году, сразу после синтеза тестостерона из холестерина Нобелевскими лауреатами А. Бутенандтом и Л. Ружичкойс (1939 год), с помощью препарата стали лечить мужской климакс.
“Тестостерона пропионат” является «золотым эталоном» для всех андрогенных и стероидных препаратов. Именно от него отталкиваются все производители при создании новых препаратов андрогенной группы.
Андрогенно/анаболический индекс “Тестостерона пропионата” равен 1/1, то есть он одинаково анаболичен и андрогенен. Эффективность препарата высока в связи с тем, что удельная масса короткого эфира пропионата меньше, чем у длинных эфиров. И чем короче эфир, тем меньше тестостерон работает в организме, и тем больше его концентрация. К примеру, после инъекции 100 мг тестостерона ципионата в организм поступает 69,90 мг действующего вещества, остаток — масса эфира. При инъекции “Тестостерона пропионата” масса основного тестостерона будет равна 83,72 мг, масса эфира пропионата, в свою очередь, гораздо меньше.
Курс терапии индивидуален, его необходимо рассчитывать для каждого больного индивидуально. Однако следует понимать, что реальная эффективная дозировка составляет не менее 400 мг в неделю для взрослого мужчины. Период активности вещества длится до трёх суток. Курс терапии может составлять до шести недель.
Препарат не вызывает такую задержку жидкости, как «длинные» эфиры тестостерона. В целом он обладает меньшими побочными эффектами, чем другие тестостероны, именно благодаря своему короткому периоду активности.
При использовании тестостерона могут проявиться определённые недостатки терапии:
- требуются частые инъекции при длинных курсах, как и все тестостероны;
- может угнетаться синтез собственного тестостерона;
- способен привести к олигоспермии;
- возможно появление гинекомастии, облысения, акне (угревой сыпи), немотивированной агрессии.
“Сустанон 250” — мощный стероид с большой андрогенной силой. Он представляет собой уникальную комбинацию четырёх эфиров тестостерона. Такое сочетание значительно повышает биодоступность и распределение препарата в организме. На протяжении 40 лет его используют спортсмены различных силовых видов спорта.
Андрогенный эффект наступает спустя 2-3 дня после первой инъекции. Оптимальная периодичность инъекций — 1 раз в 3 недели. Предпочтительный курс лечения — 6-8 недель, максимум — 10 недель. После медикаментозной паузы возможен повторный курс инъекций препарата.
“Сустанон 250” разработан голландской фармацевтической компанией «Органон» ещё в 1970-х годах для постепенного распределения тестостерона в организме. Это достигается благодаря разной скорости распределения и выведения эфиров тестостерона, входящих в состав препарата: период полураспада тестостерона пропионата — 23-49 часов, фенилпропионата — 47-100 часов, изокапроната — 119–132 часов, деканоата — до 11 суток. Максимальная концентрация тестостерона в организме наблюдается уже через два дня после введения “Сустанона”.
В целом препарат хорошо переносится, однако у него, как и у всех тестостеронов, есть “но”…
Эфиры тестостерона, входящих в состав “Сустанона 250” быстро преобразуются в эстрадиол — женский половой гормон из группы эстрогенов. Повышенная концентрация эстрогена приводит к таким побочным эффектам, как отёки, увеличение жировой массы и грудных желёз. Предотвратить эти нежелательные эффекты могут анти-эстрогены — кломифен, тамоксифен.
Иногда следует чередовать приём “Сустанона” с антагонистами ароматазы, например с “Аримидексом”, эффективно блокирующим выработку эстрогенов.
К другим побочным эффектам препарата следует отнести:
- нарушения функции печени;
- развитие приапизма — стойкой патологической эрекции;
- повышение температуры тела;
- проявление симптомов ОРЗ (боли в горле, головная боль, увеличение лимфоузлов, мышечная слабость);
- увеличение концентрации липопротеидов низкой плотности — “нежелательного” холестерина;
- частичное угнетение сперматогенеза и выработки собственного тестостерона.
Для лучшего усвоения препарата и предотвращения психических реакций (депрессий и нервных срывов) обязательно посещение спортзала — не реже 3 раз в неделю.
“Омнадрен 250” является полным аналогом препарата “Сустанон 250”, производится по лицензии польской фармацевтической компанией Jelfa S.A.
“Небидо” — наиболее популярный препарат-депо касторового масла для внутримышечных инъекций, содержащий тестостерона ундеканоат. После инъекции препарат постепенно высвобождается и затем расщепляется сывороточными эстеразами на тестостерон и ундекановую кислоту.
Возрастание концентрации тестостерона определяться уже на следующий день после инъекции. В 1 мл содержится 250 мг препарата, в последнее время обычно используют дозу 1000 мг (4 мл).
Препарат находится в организме до трёх месяцев. Кратность инъекции — 1 раз в 10-14 недель. “Небидо” присущи все побочные обычные эффекты тестостеронов.
“Андрогель” выпускают в виде геля, упакованного в пакетики. Один такой пакетик (саше) содержит 50 мг чистого тестостерона. Кроме того, появились флаконы этого препарата с дозатором. Наносится ежедневно на кожу предплечий и живота утром и поле душа. Всасывается в организм всего до 15% от нанесённой дозы.
Концентрация уровня тестостерона начинает повышаться уже с первого часа, достигая максимума в конце суток. Если гель плохо впитался в кожу, потенциально он может перенестись на контактирующих с пациентом людей (супруга , дети) и вызвать нежелательные явления (рост волос в месте контакта). Поэтому нужно следить, чтобы гель хорошо высыхал.
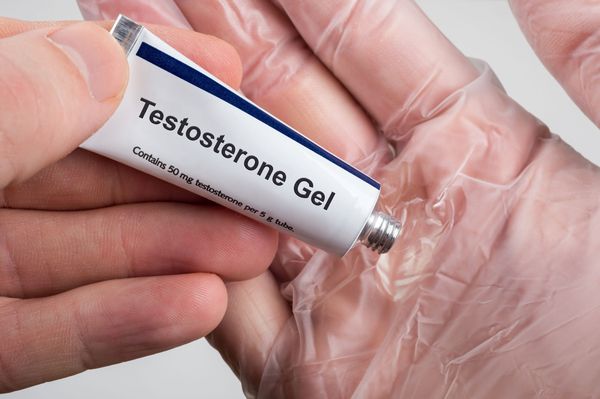
Лечение тестостероном в виде геля
Хорошим «бонусом» является локальный эффект «миолифтинга», которого нет у других препаратов. При нанесении геля на проблемные участки тела происходит улучшение функционального состояния кожи и мышц в этой зоне, «уходят» лишние жировые отложения. Этот эффект позволяет использовать “Андрогель” в комплексной терапии, совместно с пролонгированными формами тестостерона.
Кроме того, препарат можно использовать в комплексной терапии хронического простатита, обострения которого совпадают с сезонными колебаниями тестостерона. “Андрогель” помогает устранить дисбаланс и улучшить состояние.
При длительном применении “Андрогель” может оказать отрицательные эффекты, присущие тестостеронам:
- ухудшить концентрацию внимания и памяти;
- вызвать диспепсические нарушения и рост волос в нежелательных местах;
- в местах нанесении геля возможны высыпания, аллергические реакции и другие поражения кожи.
Интересен вопрос о применении, так называемых тестостероновых бустеров (тестобустеров) — химических и биологических добавок, стимулирующих выработку собственного эндогенного тестостерона. И хотя широких международных клинических исследований по тестобустерам не проводилось, и иногда данные об эффектах достаточно противоречивы, их использование может быть оправдано при незначительных и транзиторных колебаниях уровня тестостерона в крови.
Наиболее популярные тестобустеры:
- “Ярсагумба форте” — содержит экстракт эпимедиума Горянки, L-аргинин, экстракт элеутерококка колючего, L-таурин, экстракт кордицепса китайского (собственно Ярсагумба), экстракт эврикомы длиннолистной (Тонгкат), экстракт плодов маслины европейской, корня женьшеня, йохимбе, гинкго билоба и перца;
- “Бутеа суперба” — препарат на основе комплекса тайских трав;
- Блокаторы ароматазы — “Кломид”, “Тамоксифен”, 6-ОХО;
- “Икариин” — создан на основе растения Горянка;
- Агматин сульфат;
- D-аспарагиновая кислота;
- Препараты на основе красного корня (алтайский копеечник забытый);
- “Трибулус” — серия препаратов, созданная на основе растений Трибулус террестрис (якорцы стелющиеся);
- Препараты фирмы ZMA (содержат цинк, магний, витамин В6 и питательные вещества).
Заместительная витаминная терапия
При восполнении дефицита витамина D достаточно быстро в норму приходят показатели андрогенного обмена, повышается уровень тестостерона.
К препаратам, корректирующим уровень витамина D относятся:
- Колекальциферол “Merck KGaA” (Германия), представительство: ТАКЕДА (Япония);
- Колекальциферол “Medana Pharma TERPOL Group J.S.”, Co. (Польша), представительство: АКРИХИН ОАО (Россия);
- “Вигантол”;
- “Аквадетрим”;
- “Альфа Д3-Тева”.
Дозировка препаратов подбирается индивидуально, в зависимости от уровня дефицита витамина D.
Возможна передозировка витамина препаратов витамина D.
К ранним признакам гипервитаминоза витамина D относятся:
- поносы, запоры;
- сухость слизистой рта, жажда;
- головная боль;
- никтурия (ночью мочеиспускание чаще, чем днём), поллакиурия (учащённое мочеиспускание), полиурия (увеличение объёма мочи);
- анорексия, тошнота, рвота;
- металлический привкус во рту;
- гиперкальциурия (повышенное содержание кальция в моче);
- общая слабость.
К поздним симптомам гипервитаминоза витамина D относят:
- помутнение мочи (наличие гиалиновых цилиндров);
- боль в костях;
- кожный зуд;
- повышение артериального давления;
- гиперемия конъюнктивы, светобоязнь;
- сонливость;
- миалгия (боль в мышцах);
- аритмия;
- тошнота, рвота, понижение массы тела;
- редко — спутанность сознания, изменения настроения и психики.
Противопоказания к применению препаратов витамина D:
- мочекаменная болезнь;
- почечная недостаточность;
- туберкулёз в активной форме;
- острые воспалительные болезни мочеполовой системы почек;
- повышенное содержание кальция в крови.
ХГЧ-терапия
Мужские препараты, содержащие ХГЧ, увеличивают выработку тестостерона в яичках путём стимуляции клеток Лейдига. К таким препаратам относятся:
- “Гонадотропин хорионический” — 500 ЕД, 1000 ЕД, 1500 ЕД и 5000 МЕ (лиофилизат для приготовления раствора для в/м введения);
- “Овитрель” — 6500 МЕ – рекомбинантный хориогонадотропин альфа;
- “Прегнил” — 1500 МЕ, 5000 МЕ;
- “Хорагон” — 1500 МЕ, 5000 МЕ;
- “Хориомон” — 5000 МЕ.
При назначении препаратов ХГЧ следует проводить терапию, стимулирующую сперматогенез.
Прогноз. Профилактика
При вовремя начатом лечении прогноз благоприятный (за исключением наследственных форм андрогенной недостаточности и критических стадий возрастного андрогенного дефицита).
К методам профилактики андрогенного дефицита относятся:
- физическая и сексуальная активность;
- полноценное питание с необходимым витаминным балансом;
- постоянное пребывание на свежем воздухе, регулярный приём солнечных ванн, контроль уровня витамина D;
- контроль массы тела, уровня сахара и холестерина в крови;
- своевременное лечение хронических заболеваний;
- контроль уровня тестостерона в крови — 1 раз в год;
- регулярное ежегодное посещение врача-андролога, уролога.
Список литературы
- Hackett G, Kirby M.Int J Clin Pract. Erectile dysfunction and testosterone deficiency as cardiovascular risk factors? — 2018; 72(2).
- Винаров А.З., Роживанов Р.В. Влияние терапии трансдермальным препаратом тестостерона на качество жизни мужчин с андрогендефицитом и хроническим простатитом в условиях рутинной клинической практики // Урология. — 2018. — № 1. — С. 71-76.
- Vinarov AZ, Rozhivanov RV. Effect of transdermal testosterone on the quality of life of men with androgen deficiency and chronic prostatitis in routine clinical practice // Urologiia. — 2018; (1):71-76.
- Zhang LY, He W, Wan JX, Yin QQ, et al. Hypogonadism and the quality of life in male patients with type-2 diabetes mellitus // Zhonghua Nan Ke Xue. —2016; 22(12):1088-1094.
- Nieschlag E, Behre HM, Nieschlag S. Andrology: Male Reproductive Health and Dysfunction. — 2010. — Р. 29- 97.
- Holmboe SA, Skakkebæk NE, Juul A, Scheike T, et al. Individual testosterone decline and future mortality risk in men // Eur J Endocrinol. — 2018; 178(1):123-130.
- Fu L, Liu Y, Wang J, Sun Y, et al. Cardioprotection by Low-dose of Estrogen and Testosterone at the Physiological Ratio on Ovariectomized Rats During Ischemia/Reperfusion Injury // J Cardiovasc Pharmacol. — 2017; 70(2):87-93.
- Giltay EJ, Gooren LJ. Potential side effects of androgen deprivation treatment in sex offenders // J Am Acad Psychiatry Law. — 2009; 37(1):53-8.
- Dörner G. On the problem of neuroendocrine pathogenesis, prevention and therapy of congenital sex deviations // Dtsch Med Wochenschr. — 1969; 94(8):390-6.
- Hohlweg W. The significance of sex hormones secreted by fetal gonads for the development of the sex-specific genital apparatus and for the determination of heterosexual or homosexual behavior // Wien Med Wochenschr. — 1971; 121(51):927-32.
- Levine LS, New MI, Pitt P, Peterson RE. Androgen production in boys with sexual precocity and congenital adrenal hyperplasia // Metabolism. — 1972; 21(5):457-64.
- Stellato RK, Feldman HA, Hamdy O. Testosterone, sex hormone-binding globulin, and the development of type 2 diabetes in middle-aged men: prospective results from the Massachusetts male aging study // Diabetes Care. —2000; 23:490-4.
- Wolf-Bernhard Schill WB, Frank H. Comhaire, Timothy B. Andrologia clinica // Hargreave. — 2010.
- Jockenhovel F. Male Hyрogonadism // Auflage-Bremen: Uni-Med. — 2004. — 185 р.
- Wang C., Nieschlag E., Swerdloff R. et al. Investigation, treatment and monitoring of late-onset hypogonadism in males: ISA, ISSAM, EAU, EAA and ASA recommendations // Eur J Endocrinol. — 2008; 159(5):507-14.
- Grzegorczyk K., Krajewska M., Weyde W. et al. Gender and kidney diseases: the clinical importance and mechanisms of modifying effects // Postepy Hig Med Dosw. — 2011; 65:849-57.
- Iglesias P., Carrero J.J., Díez J.J. Gonadal dysfunction in men with chronic kidney disease: clinical features, prognostic implications and therapeutic options // J Nephrol. — 2012; 25(1):31-42.
- Gorbachinsky I., Akpinar H., Assimos D.G. Metabolic syndrome and urological diseases // Rev Urol. — 2010; 12(4):157–80.
- Stellato RK., Feldman HA., Hamdy O, Horton ES, et al. Testosterone, sex hormone-binding globulin, and the development of type 2 diabetes in middle-aged men: prospective results from the Massachusetts male aging study // Diabetes Care. — 2000; 23(4):490-4.
- Тюзиков И.А., Калинченко С.Ю., Ворслов Л.О., Тишова Ю.А. Место андрогенного дефицита в клиническом портрете современного урологического пациента // Андрология и генитальная хирургия. — 2013. — № 2. — С. 48-57.
- Traish A.M., Miner M.M., Morgentaler A., Zitzmann M. Testosterone deficiency // Am J Med. — 2011; 124(7):578-87.
- Dohle G.R., Arver S., Bettocchi C. et al. Guidelines on male hypogonadism // EAU. — 2013. — 27 р.
- McHenry Martin C. Testosterone deficiency in older men: a problem worth treating // Сonsult Pharm. — 2012; 27(3):152-63.
- Spetz Holm A.C., Fredrikson M.G., Hammar M.L. Symptoms of testosterone deficiency in early middle aged men // Aging Male. — 2012; 15(2):78-84.
- Mazer N.A., Shifren J.L. Transdermal testosterone for women: a new physiological approach for androgen therapy // Obstet Gynecol Surv. — 2003; 58(7):489-500.
- Chudakov B., Ben Zion I.Z., Belmaker R.H. Transdermal testosterone gel prn application for hypoactive sexual desire disorder in premenopausal women: a controlled pilot study of the effects on the Arizona sexual experiences scale for females and sexual function questionnaire // J Sex Med. — 2007; 4(1):204-8.
- Raghunandan C., Agrawal S., Dubey P. et al. A comparative study of the effects of local estrogen with or without local testosterone on vulvovaginal and sexual dysfunction in postmenopausal women // J Sex Med. — 2010; 7(3):1284-90.
- Lin E., McCabe E., Newton-Cheh C. et al. Effects of transdermal testosterone on natriuretic peptide levels in women: a randomized placebo-controlled pilot study // Fertil Steril. — 2012; 97(2):489-93.
- Trummer C, Pilz S, Schwetz V, Obermayer-Pietsch Bб et al. Vitamin D, PCOS and androgens in men: a systematic review // Endocr Connect. — 2018; 7(3):95-113.
Дифференциальная диагностика
Раздел “Дифференциальная диагностика” предоставляет подробный обзор методик и подходов, необходимых для различения андрогенного дефицита от других медицинских состояний со схожими симптомами. Эффективное различение этих состояний позволяет врачам назначить наиболее адекватное лечение и минимизировать риски неправильной терапии.
Прежде чем приступить к постановке диагноза, следует рассмотреть множество факторов, которые могут быть ответственны за симптоматику, аналогичную андрогенному дефициту. Ниже приведены основные этапы, используемые для дифференциальной диагностики:
Клиническая оценка
Первый шаг в процессе диагностики включает тщательное клиническое обследование пациента:
- Сбор анамнеза: Включает в себя вопросы о наличии хронических заболеваний, операциях, медикаментозной терапии и образе жизни.
- Оценка симптомов: Врач анализирует симптомы, такие как утомляемость, снижение полового влечения, депрессия и изменение массы тела.
- Физикальное обследование: Особое внимание уделяется внешним изменениям, характерным для андрогенного дефицита, например, уменьшению волосяного покрова или снижению мышечной массы.
Лабораторные исследования
Для подтверждения или исключения диагноза андрогенного дефицита, назначают анализы:
- Тестостерон: Измерение уровней общего и свободного тестостерона в сыворотке крови.
- Лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ): Эти гормоны помогают различить первичный и вторичный андрогенный дефицит.
- Дополнительные анализы: Уровни пролактина, щитовидной железы, а также сахар в крови.
Инструментальные методы
В некоторых случаях могут потребоваться инструментальные методы обследования:
- Ультразвуковое исследование (УЗИ): Оценивает состояние органов малого таза и яичек.
- Магнитно-резонансная томография (МРТ): Используется для обнаружения гипоталамо-гипофизарных аномалий.
- Денситометрия: Измерение плотности костной ткани при подозрении на остеопороз.
Исключение других состояний
Не менее важным этапом является исключение других заболеваний, которые могут проявляться аналогичными симптомами:
- Депрессия: Могут понадобиться психиатрические консультации и обследования.
- Сахарный диабет: Обследование на наличие признаков нарушения углеводного обмена.
- Болезни щитовидной железы: Оценка функции щитовидной железы с помощью тестов уровня ТТГ и Т4.
- Хроническая почечная недостаточность: Анализы крови для оценки функций почек и электролитного баланса.
Таким образом, комплексный подход к дифференциальной диагностике позволяет точно установить заболевание и выбрать оптимальную стратегию лечения, что в конечном итоге улучшает качество жизни пациента. Этот раздел иллюстрирует важность многоплановой оценки и применения как клинических, так и лабораторных методов для точного диагноза.
Видео по теме:
Вопрос-ответ:
Что такое андрогенный дефицит и как он проявляется у мужчин?
Андрогенный дефицит, или гипогонадизм, представляет собой состояние, при котором мужской организм не производит достаточное количество тестостерона, основного мужского гормона. Это может проявляться различными симптомами, включающими снижение полового влечения, эректильную дисфункцию, утомляемость, депрессию, потерю мышечной массы, увеличение жировой ткани и снижение плотности костей. У молодых мужчин это состояние может также привести к задержкам в половом развитии.
Какие методы диагностики используются для выявления андрогенного дефицита?
Диагностика андрогенного дефицита включает в себя сбор анамнеза, физическое обследование и лабораторные тесты. Врач обычно проведет подробное интервью, чтобы узнать о симптомах и их продолжительности. Важно также оценить общее состояние здоровья пациента, заболевания, которые могут повлиять на уровень тестостерона. Основным лабораторным тестом является измерение уровня тестостерона в крови, чаще всего в утренние часы, когда его концентрация максимальна. Дополнительно могут быть назначены исследования уровня других гормонов, ультразвуковое исследование яичек и тесты на плотность костной ткани.
Какие причины могут вызывать гипогонадизм у мужчин?
Гипогонадизм у мужчин может быть вызван различными причинами. Поражения гипоталамуса или гипофиза, которые контролируют выработку тестостерона, могут приводить к центральному гипогонадизму. Проблемы с яичками, такие как травмы, инфекции, а также генетические заболевания (например, синдром Клайнфельтера), могут вызвать первичный гипогонадизм. Хронические заболевания, такие как диабет или ожирение, также влияют на уровень тестостерона. Кроме того, старение естественным образом связано со снижением уровня тестостерона. Некоторые медикаменты и химиотерапия могут тоже стать причиной развития данного состояния.
Можно ли лечить андрогенный дефицит и какими методами?
Лечение андрогенного дефицита возможно, и его цели включают в себя нормализацию уровня тестостерона и улучшение качества жизни пациента. Основным методом лечения является заместительная терапия тестостероном, которая может проводиться в различных формах: инъекции, гели, пластыри или таблетки. Каждая форма имеет свои преимущества и недостатки и подбирается индивидуально. Важно, чтобы лечение проводилось под контролем врача, так как возможны побочные эффекты, такие как увеличение риска сердечно-сосудистых заболеваний или рак предстательной железы. В некоторых случаях может потребоваться лечение основной причины гипогонадизма, например, лечение заболеваний гипоталамо-гипофизарной системы или изменение образа жизни при ожирении.
Можно ли предотвратить андрогенный дефицит у мужчин?
Полностью предотвратить андрогенный дефицит не всегда возможно, особенно если он связан с генетическими заболеваниями или процессом старения. Однако некоторые меры могут снизить риск его развития. Важно поддерживать здоровый образ жизни: правильное питание, регулярные физические нагрузки и поддержание нормального веса могут способствовать поддержанию нормального уровня тестостерона. Избегание стрессов, контроль хронических заболеваний, таких как диабет и гипертония, также играют ключевую роль. Регулярные медицинские обследования помогут своевременно выявить и лечить заболевания, которые могут негативно влиять на выработку тестостерона.